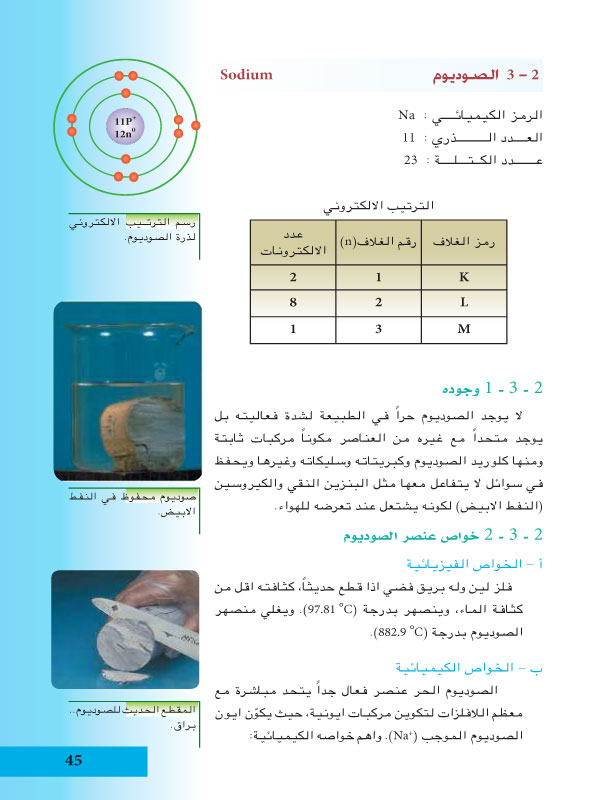
العدد الذري للصوديوم

العدد الذري هو عدد البروتونات الموجودة في نواة ذرة عنصر ما. والصوديوم عنصر كيميائي له العدد الذري 11، مما يعني أن نواة ذرة الصوديوم تحتوي على 11 بروتونًا.

خصائص الصوديوم

الصوديوم معدن قلوي ناعم وفضي اللون. وهو شديد التفاعل مع الماء والهواء ويمكن أن يتسبب في حدوث حروق إذا لامس الجلد. والصوديوم له العديد من الاستخدامات، بما في ذلك:

- إنتاج ملح الطعام (كلوريد الصوديوم)
- صنع الصابون والمنظفات
- استخدامه كوقود في مصابيح الشوارع والألعاب النارية

موقع الصوديوم في الجدول الدوري

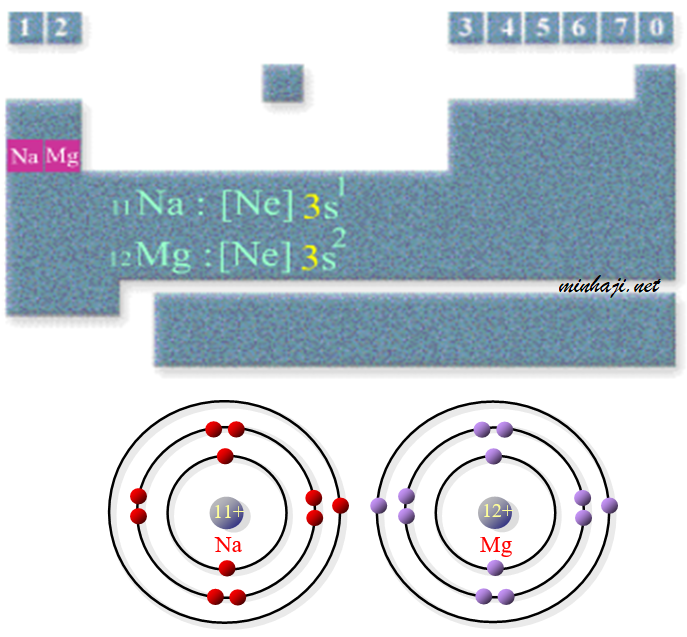
يقع الصوديوم في المجموعة الأولى (المعادن القلوية) والدورة الثالثة من الجدول الدوري. يقع فوق البوتاسيوم وتحت الليثيوم. والصوديوم له التوزيع الإلكتروني التالي:
1s22s22p63s1
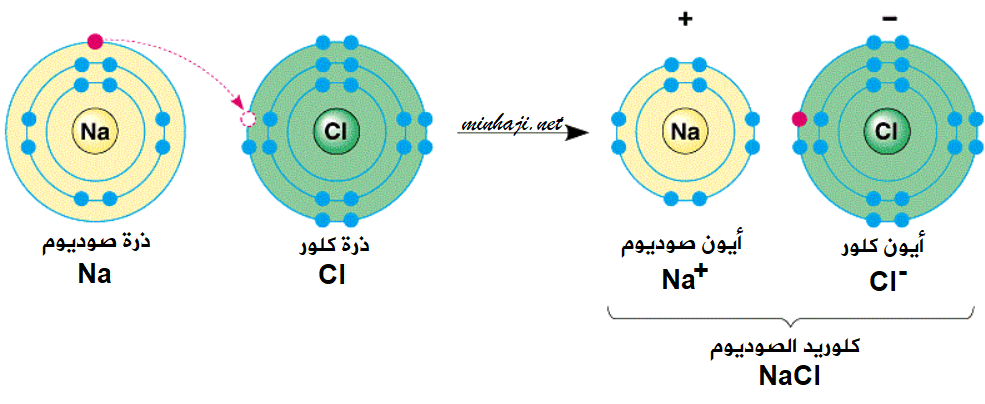
أيون الصوديوم
عندما يفقد الصوديوم إلكترونًا واحدًا، فإنه يتحول إلى أيون موجب الشحنة يسمى أيون الصوديوم. ويتم تمثيل أيون الصوديوم بالرمز Na+. وأيون الصوديوم ضروري للعديد من الوظائف البيولوجية، بما في ذلك:

- تنظيم توازن السوائل
- نقل النبضات العصبية
- تقلص العضلات

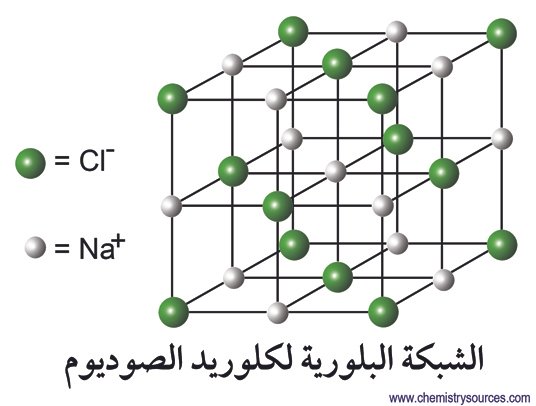
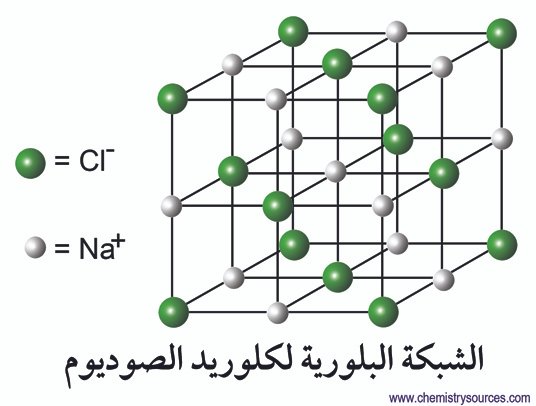
مركبات الصوديوم

يشكل الصوديوم مجموعة واسعة من المركبات، بما في ذلك:

- كلوريد الصوديوم (ملح الطعام)
- هيدروكسيد الصوديوم (الصودا الكاوية)
- كربونات الصوديوم (صودا الغسيل)

دور الصوديوم في الجسم

الصوديوم معدن أساسي للجسم. وهو ضروري للعديد من الوظائف، بما في ذلك:

- تنظيم توازن السوائل
- نقل النبضات العصبية
- تقلص العضلات

نقص الصوديوم
يمكن أن يؤدي نقص الصوديوم (نقص صوديوم الدم) إلى مجموعة من الأعراض، بما في ذلك:

- الصداع
- الغثيان
- التشنجات

استنتاج
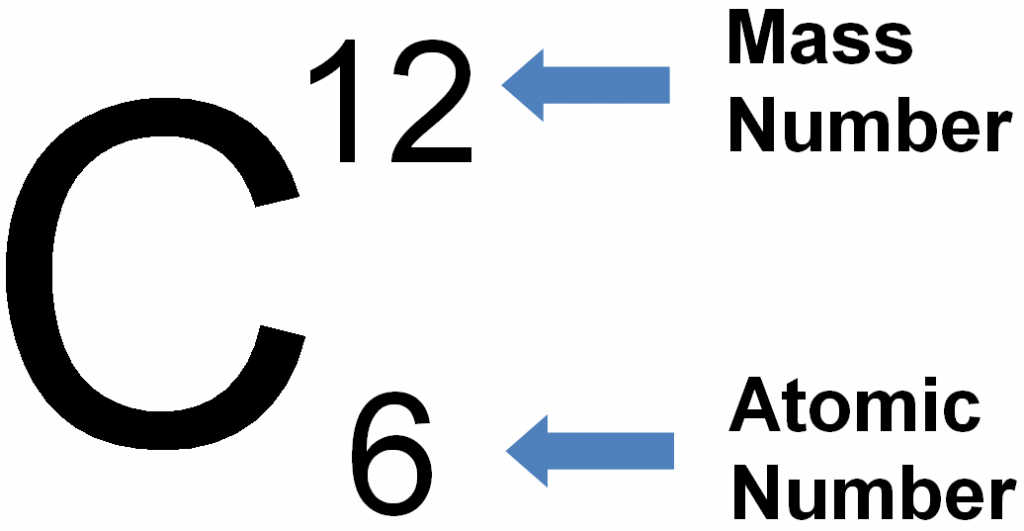
العدد الذري للصوديوم هو 11. وهو معدن قلوي ناعم وفضي اللون. والصوديوم له العديد من الاستخدامات، بما في ذلك إنتاج ملح الطعام وصنع الصابون والمنظفات. والعنصر ضروري للعديد من الوظائف البيولوجية، بما في ذلك تنظيم توازن السوائل ونقل النبضات العصبية وتقلص العضلات.
