سرعة التفاعل الكيميائي

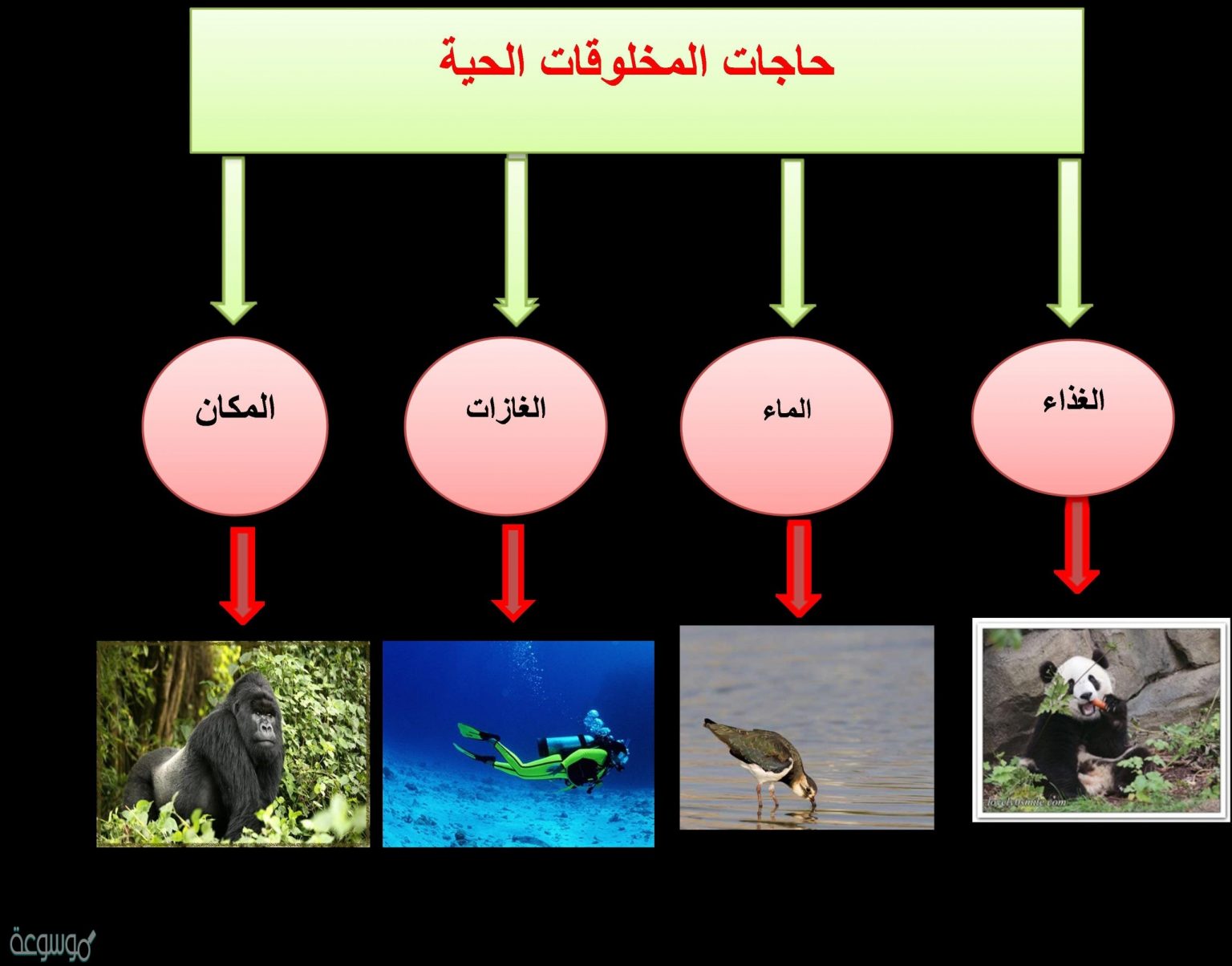
سرعة التفاعل الكيميائي هي معدل حدوث التفاعل الكيميائي، أي التغير في تركيز المتفاعلات أو النواتج بمرور الوقت. هناك العديد من العوامل التي تؤثر على سرعة التفاعل، مثل تركيز المتفاعلات، ودرجة الحرارة، والمحفزات، ومساحة السطح، وطبيعة المتفاعلات.
تركيز المتفاعلات

كلما زاد تركيز المتفاعلات، زادت سرعة التفاعل. وذلك لأن زيادة التركيز يعني زيادة عدد جزيئات المتفاعلات المتصادمة في وحدة زمنية، مما يزيد من احتمالية حدوث التفاعل.

على سبيل المثال، إذا تضاعف تركيز أحد المتفاعلات، فتتضاعف سرعة التفاعل أيضًا. وإذا تضاعف تركيز المتفاعلين، فتتضاعف سرعة التفاعل بأربع مرات.
درجة الحرارة

تزداد سرعة التفاعل مع زيادة درجة الحرارة. وذلك لأن زيادة درجة الحرارة تزيد من الطاقة الحركية للجزيئات، مما يزيد من احتمالية تصادمها ببعضها البعض بالطاقة الكافية للتفاعل.

وفقًا لقاعدة أرينيوس، تزداد سرعة التفاعل بمقدار 2-4 أضعاف لكل زيادة في درجة الحرارة بمقدار 10 درجات مئوية.

المحفزات

المحفزات هي مواد تزيد من سرعة التفاعل دون أن تُستهلك في التفاعل. تعمل المحفزات عن طريق توفير مسار بديل للتفاعل ذي طاقة تنشيط منخفضة، مما يجعل التفاعل أسرع.

على سبيل المثال، يستخدم البلاتين كمحفز في تفاعل تحويل غاز العادم إلى غاز عديم اللون.

مساحة السطح
تزداد سرعة التفاعل مع زيادة مساحة سطح المتفاعلات. وذلك لأن زيادة مساحة السطح تزيد من عدد المواقع المتاحة للتفاعل.

على سبيل المثال، يتفاعل مسحوق الحديد بشكل أسرع من قطعة حديد صلبة لأن مسحوق الحديد له مساحة سطح أكبر.

طبيعة المتفاعلات

تؤثر طبيعة المتفاعلات أيضًا على سرعة التفاعل. بشكل عام، تتفاعل الجزيئات الأصغر بشكل أسرع من الجزيئات الأكبر، وتتفاعل الجزيئات ذات الروابط الأضعف بشكل أسرع من الجزيئات ذات الروابط الأقوى.

على سبيل المثال، يتفاعل الهيدروجين مع الأكسجين بشكل أسرع من النيتروجين مع الأكسجين لأن جزيء الهيدروجين أصغر وله روابط أضعف.

غياب العوامل المؤثرة

هناك عامل واحد لا يؤثر على سرعة التفاعل الكيميائي، وهو:
توازن التفاعل

توازن التفاعل هو النقطة التي تتساوى فيها معدلات التفاعل الأمامي والعكسي، ولا يحدث تغيير صافٍ في تركيز المتفاعلات أو النواتج. يؤثر توازن التفاعل على تركيب التفاعل النهائي، ولكن ليس على سرعة التفاعل.
الخاتمة

تلعب العديد من العوامل دورًا في تحديد سرعة التفاعل الكيميائي، بما في ذلك تركيز المتفاعلات، ودرجة الحرارة، والمحفزات، ومساحة السطح، وطبيعة المتفاعلات. من خلال فهم هذه العوامل، يمكن التحكم في سرعات التفاعل وتسريعها أو إبطائها حسب الحاجة.
