قانون سرعة التفاعل

يصف قانون سرعة التفاعل المعدل الذي تحدث عنده التفاعلات الكيميائية. ويعرف بمعدل تغير تركيز المتفاعلات أو النواتج بمرور الوقت. ويتم التعبير عن قانون سرعة التفاعل عادةً بالمعادلة التفاضلية التالية:

“`
rate = -d[A]/dt = -d[B]/dt = … = d[C]/dt = … = d[D]/dt

“`


حيث:
[A] و [B] و … و [C] و [D] هي تركيزات المتفاعلات والناتجات
t هو الوقت

عوامل تؤثر على سرعة التفاعل

هناك العديد من العوامل التي يمكن أن تؤثر على سرعة التفاعل، منها:
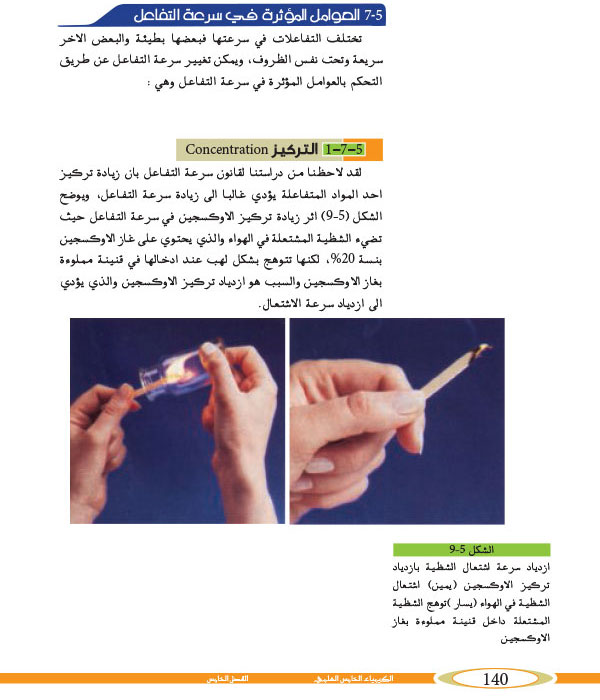
تركيز المتفاعلات: كلما زاد تركيز المتفاعلات، زادت سرعة التفاعل.

درجة الحرارة: يؤدي زيادة درجة الحرارة إلى زيادة سرعة التفاعل بشكل عام.

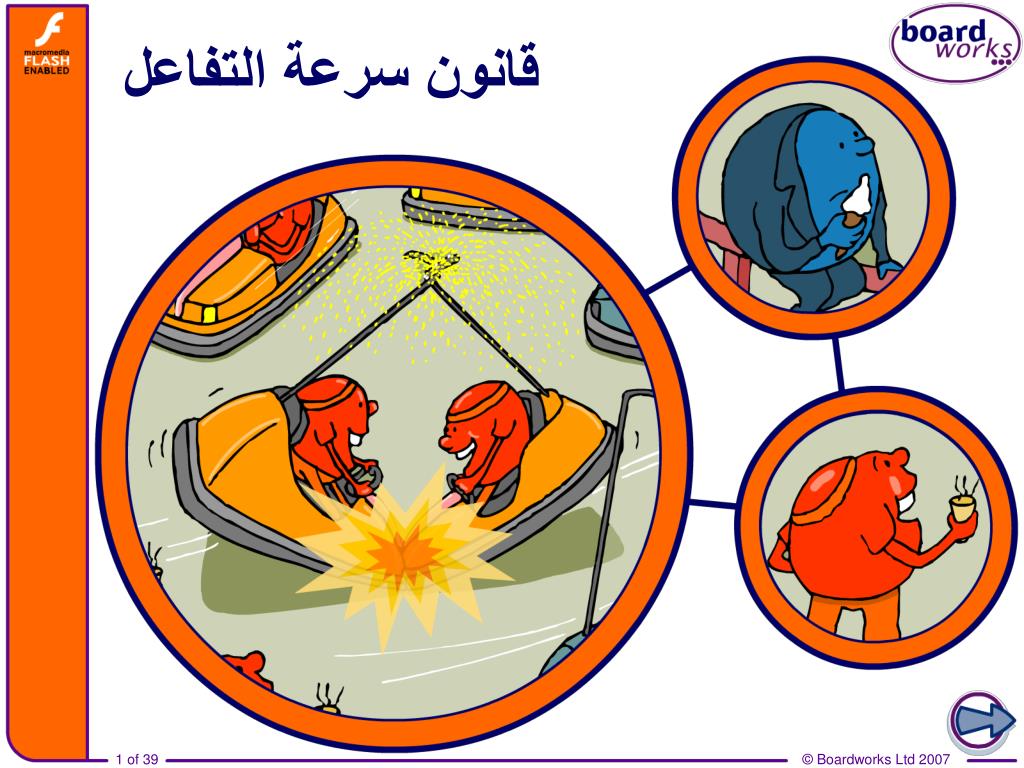
المحفزات: المواد التي تزيد من سرعة التفاعل دون استهلاكها.

مساحة السطح: كلما زادت مساحة السطح للمتفاعلات، زادت سرعة التفاعل.

القطبية: يؤثر نوع المذيب على سرعة التفاعل بين الأيونات أو الجزيئات القطبية.

القوة الأيونية: يؤدي زيادة القوة الأيونية للمحلول إلى تقليل سرعة التفاعلات الأيونية.

الضوء: يمكن أن يؤدي الضوء إلى تسريع بعض التفاعلات، مثل تفاعلات الأكسدة والاختزال.

ويعتمد قانون سرعة التفاعل على الآلية الدقيقة للتفاعل، والتي يمكن أن تكون معقدة للغاية. ويتم تحديد قانون السرعة عادةً تجريبياً من خلال قياس تركيزات المتفاعلات والناتجات بمرور الوقت.
تطبيقات قانون سرعة التفاعل

لقانون سرعة التفاعل العديد من التطبيقات المهمة في الكيمياء، منها:

التنبؤ بمعدل التفاعلات: يمكن استخدام قانون السرعة للتنبؤ بمعدل التفاعلات في ظل ظروف مختلفة.
تصميم المحفزات: يمكن استخدام قانون السرعة لتصميم محفزات أكثر فعالية.

تحسين العمليات الكيميائية: يمكن استخدام قانون السرعة لتحسين العمليات الكيميائية، مثل تفاعلات التصنيع الدوائي.

خاتمة

قانون سرعة التفاعل هو أداة مهمة لفهم وتحكم التفاعلات الكيميائية. ويمكن استخدامه للتنبؤ بمعدل التفاعلات، وتصميم المحفزات، وتحسين العمليات الكيميائية.
